Hidrolisis adalah penguraian/pemecahan oleh air. komponen garam baik kation maupun anion yang berasal dari asam lemah atau basa lemah akan bereaksi dengan air/terhidrolisis. Sedangkan kation dan anion garam yang berasal dari asam kuat dan basa kuat tidak dapat bereaksi dengan air.
Jenis-jenis Garam berdasarkan asam basa penyusunnya:
Garam dari asam kuat dan basa kuat. (Tidak terhidrolisis)
Garam ini tidak akan bereaksi dengan air. Hal ini disebabkan kation dan anionnya berasal dari asam kuat dan basa kuat. kation dan anion yang berasal dari asam kuat dan basa kuat akan memiliki sifat berkebalikan menjadi basa lemah dan asam lemah. Nilai pH larutan garamnya = 7 (netral). Garam ini disebut tidak terhidrolisis.
Contoh:
Reaksi Hidrolisis NaCl
NaCl ® Na+ (aq) + Cl−
Na+ (aq) + H2O(l) ® (tidak bereaksi)
Cl− (aq)+ H2O(l) ® (tidak bereaksi)
Contoh Soal:
Tentukan pH dari 10ml larutan NaCl 2 M
Jawaban:
pH = 7 (netral), karena garamnya berasal dari asam kuat dan basa kuat.
garam dari asam kuat dan basa lemah. (Hidrolisis sebagian/parsial)
Contoh:
Reaksi Hidrolisis dari NH4Cl
NH4+ + H2O → NH4OH + H+
Cl− + H2O ® (tidak bereaksi)
Karena menghasilkan ion H+ maka garam ini akan bersifat asam, jumlah [H+] dapat dihitung melalui rumus:
Perhitungan pH
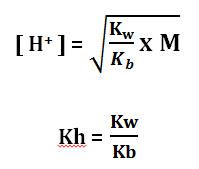
pH = – log [H+]
Keterangan:
Kw = Tetapan Ionisasi Air = 10-14
Kb = tetapan ionisasi basa lemah
M = Molaritas Kation
Kh = Tetapan hidrolisis
Tipe soal I: Jika diketahui di soal hanya garam maka langsung masuk rumus.
Contoh Soal:
Tentukan pH dari larutan (NH4)2SO4 0,05 M (Kb NH3 = 10-5)
Jawaban:
![]()
Jumlah kationnya (NH4+) berjumlah 2 maka konsentrasi dikali 2
pH = 5
Tipe soal II:
Jika diketahui di soal asam dan basanya. Maka harus direaksikan dengan metode m, r , s
Contoh Soal:
Larutan 1L NH4OH 2 M bereaksi dengan 1 L H2SO4 1 M tentukan pH campuran!
Jawaban:
Reaksi :
. 2NH4OH(aq) + H2SO4(aq) → (NH4)2SO4 + 2H2O
Mula2 2 mol 1 mol − −
Reaksi 2 1 − 1 2 +
Sisa − − 1 mol 2 mol
Ciri Hidrolisis:
Asam dan Basa akan habis
Menentukan M garam

Masuk Rumus :
![]()
pH = 4,5
Garam dari asam lemah dan basa kuat. (Hidrolisis sebagian/parsial)
Contoh : CH3COONa (berasal dari CH3COOH) dan NaOH), KCN (berasal dari KOH dan HCN)
Garam ini akan terhidrolisis sebagian karena hanya salah satu ion yang bereaksi dengan air yaitu ion negatif (anion) yang berasal dari asam lemah.
Contoh Reaksi Hidrolisis CH3COONa adalah
CH3COO− + H2O → CH3COOH + OH−
Na+ + H2O ® (Tidak bereaksi)
Karena menghasilkan ion OH− maka garam ini akan bersifat basa
Perhitungan pH

pOH = – log [OH−]
pH = 14 – pOH
Keterangan:
Kw = tetapan kesetimbangan air = 10-14
Ka = tetapan ionisasi asam lemah
M = Molaritas anion
Tipe soal I: Jika diketahui di soal hanya garam maka langsung masuk rumus.
Contoh Soal:
Tentukan pH dari larutan CH3COONa 0,1 M (Ka CH3COOH = 10-5)
Jawaban:
![]()
Jumlah anionnya (CH3COO−) berjumlah 1 maka konsentrasi dikali 1
pOH = 5
pH = 14 – 5 = 9
Tipe soal II:
Jika diketahui di soal asam dan basa. Maka harus direaksikan dengan metode m, r , s
Contoh Soal:
Larutan 0,5L KOH 2M bereaksi dengan 0,5 L HCN 2M tentukan pH campuran!
Jawaban:
Reaksi :
KOH(aq) + HCN(aq) → KCN + H2O
Mula2 1 mol 1 mol − −
Reaksi 1 1 − 1 1 +
Sisa − − 1 mol 1 mol
Ciri Hidrolisis
Asam dan Basa akan habis
Menentukan M garam
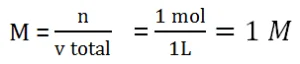
Masuk Rumus :
![]()
pOH = 4,5
pH = 14 – 4,5 = 9,5
Garam dari asam lemah dan basa lemah. (Hidrolisis sempurna)
Contoh : NH4CN (berasal dari NH4OH dan HCN)
Garam ini akan terhidrolisis sempurna yaitu ion positif (kation) yang berasal dari basa
lemah.dan ion negatif (anion) yang berasal dari asam lemah.
Contoh reaksi hidrolisis NH4CN adalah
NH4+ + H2O → NH4OH + H+
CN− + H2O → HCN + OH−
Sifat asam dan basa ditentukan oleh besarnya Ka dan Kb, Jika:
Ka > Kb garam akan bersifat asam
Ka < Kb garam akan bersifat basa
Ka = Kb garam akan bersifat netral
Perhitungan pH
Jika Ka > Kb (garam asam) Rumusnya:
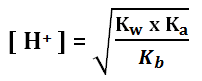
Jika Ka < Kb (garam basa) Rumusnya:
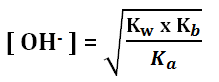
Keterangan:
Kw = tetapan kesetimbangan air = 10-14
Kb = tetapan ionisasi basa lemah
Ka = tetapan ionisasi asam lemah
Contoh Soal:
Tentukan pH dari larutan NH4CN 0,05 M (Kb NH3 = 10-5, Ka HCN = 10-8)
Jawaban:
Ka < Kb maka akan bersifat basa
![]()
pOH = 5,5
pH = 14 – 5,5 = 8,5ontoh Soal & Pembahasan Hidrolisis
Jelaskan apa yang dimaksud dengan hidrolisis garam?
PEMBAHASAN :
Reaksi antara ion garam dengan air.
Apa yang dimaksud dengan hidrolisis parsial? Berikan contohnya
PEMBAHASAN :
Hidrolisis parsial yaitu bereaksinya sebagian ion dari garam dengan air. Contohnya pada garam yang terbentuk dari Asam lemah dan basa kuat CH3COONa. Yang bereaksi dengan air hanya ion CH3COO--, ion Na+ tidak bereaksi dengan air
Apakah semua garam dapat mengalami hidrolisis? Jelaskan dan berikan contohnya.
PEMBAHASAN :
Tidak semua garam dapat mengalami hidrolisis. Beberapa jenis garam diantaranya:
- Garam dari asam kuat dan basa kuat, contoh : NaCl tidak mengalami hidrolisis
- Garam dari asam lemah dan basa kuat atau dari asam kuat dan basa lemah mengalami hidrolisis parsial/sebagian, contohnya: KCN atau AgCl
- Garam dari asam lemah dan basa lemah, mengalami hidrolisis sempurna/total, contohnya : CH3COOCN
Lakukan analisis apakah larutan garam berikut ini mengalami hidrolisis. Jika mengalami hidrolisis, tuliskan reaksi hidrolisisnya.
a. Pb(NO3)2
b. (NH4)2CO3
c. KNO3
d. MgSO4
e. Na2HPO4
2NO3-- + H2O → tidak bereaksi (terhidrolisis parsial/sebagian)
CO32- + 2H2O → H2CO3 + 2OH-- (terhidrolisis sempurna/total)
NO3-- + H2O → tidak bereaksi (tidak terhidrolisis)
SO42- + H2O → tidak bereaksi (terhidrolisis sebagian/parsial)
HPO42- + H2O → H2PO4-- + OH-- (terhidrolisis sebagian/parsial)
- AlCl3
- CuSO4
- Ba(NO3)2
- KCN
- Na2CO3
PEMBAHASAN :
Untuk menentukan sifat asam atau basa suatu garam, bisa menentukan langsung dari asam atau basa penyusunnya. Sifat garam akan mengikuti asal yang bersifat kuat. Jika yang kuat asam maka garam akan bersifat asam, jika yang kuat basa maka yang garam bersifat basa. Jika keduanya kuat akan bersifat netral. Jika keduanya lemah, maka akan bergantung pada nilai Ka dan Kb
- AlCl3 bersifat asam karena berasal dari asam kuat HCl dan basa lemah Al(OH)3, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna merah
- CuSO4 bersifat asam karena berasal dari asam kuat H2SO4 dan basa lemah Cu(OH)2, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna merah
- Ba(NO3)2 bersifat netral karena berasal dari asam kuat HNO3 dan basa kuat Ba (OH)2, jika dimasukan lakmus merah akan berwarna merah. Jika dimasukan lakmus biru akan berwarna biru
- KCN bersifat basa karena berasal dari asam lemah HCN dan basa kuat KOH, jika dimasukan lakmus merah akan berwarna biru. Jika dimasukan lakmus biru akan berwarna biru
- Na2CO3 bersifat basa karena berasal dari asam lemah H2CO3 dan basa kuat NaOH, jika dimasukan lakmus merah akan berwarna biru. Jika dimasukan lakmus biru akan berwarna biru
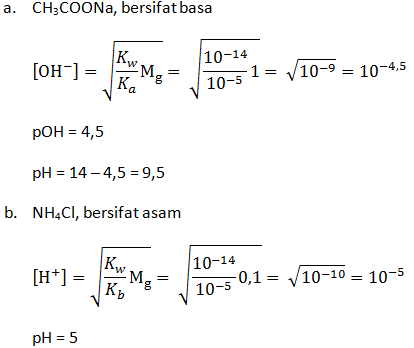
Hitunglah pH larutan:
- CH3COONa 1 M (Ka CH3COOH = 1 x 10-5)
- NH4Cl 0,1 M (Kb NH4OH = 1 x 10-5)
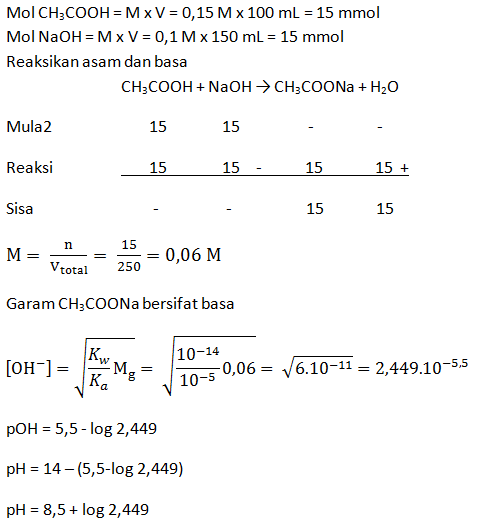

Hitunglah pH larutan dari:
- Larutan NaCN 0,1 M (Ka HCN = 4 x 10-6)
- CH3COONH4 0,1 M ( Ka CH3COOH = 1 x 10-5 dan Kb NH3 = 1 x 10-5)
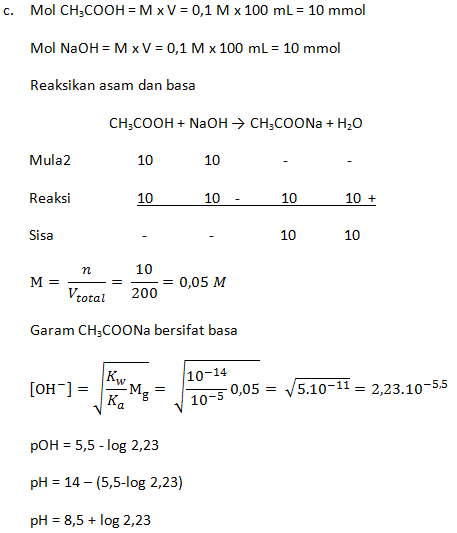
- Campuran 100 mL CH3COOH 0,1 M dengan 100 mL larutan NaOH 0,1 M (Ka = 1 x 10-5)
- Campuran 200 mL NH3 0,3 M dengan 300 mL HCl 0,2 M (Kb = 1 x 10-5)
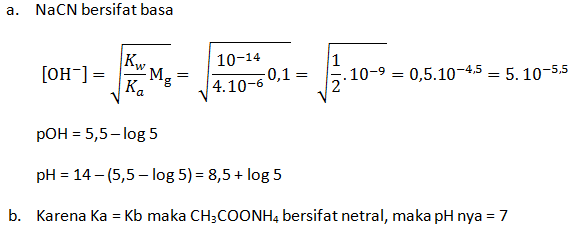


- 9,5
- 10,0
- 11,5
- 12,5
- 13,0
HCN merupakan asam lemah dan KOH merupakan basa kuat. Jika ada asam dan basa maka reaksikan terlebih dahulu.
Menentukan mol HCN
n = M x V = 0,1 M x 200 mL = 0,1 M x 0,2 L= 0,02 mol
Menentukan mol KOH


Karena kedua pereaksi habis maka termasuk hidrolisis yang ditinjau adalah garam. Garam yang di hasilkan dari reaksi HCN dan KOH akan bersifat basa karena terbentuk dari basa kuat dan asam lemah (hidrolisis lihat siapa yang kuat)
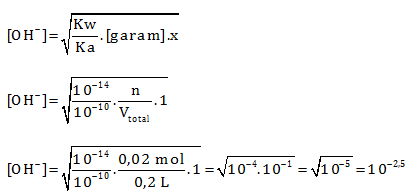
pOH = 2,5
pH = 14 – 2,5 = 11,5
Jawaban C
- 4 – log 2
- 5 – log 4
- 10 + log 2
- 10 – log 2
- 10 + log 4
KClO merupakan garam yang terbentuk dari KOH(Basa kuat) dan HClO (asam lemah), maka sifat garamnya bisa dilihat dari yang kuat yaitu basa. Maka pH nya dapat ditentukan dengan rumus


pOH = 4 – log 2
pH = 14 – (4 – log 2) = 10 + log 2
Jawaban C
- 4 – log 2
- 6 + log 4
- 6 – log 2
- 8 + log 2
- 8 – log 4
NH4Cl merupakan garam yang terbentuk dari NH4OH(basa lemah) dan HCl (asam kuat), maka sifat garamnya bisa dilihat dari yang kuat yaitu asam. Maka pH nya dapat ditentukan dengan rumus

[H+] = 2. 10-6
pH = 6 – log 2
Jawaban C
- 9 – log 5
- 8 + log 5
- 8 – log 5
- 6 + log 5
- 6 – log 5
Menentukan mol NH3 dan HCl sebelum direaksikan
n NH3 = M x V = 0,1 M x 250 mL = 25 mmol (NH3 dan H2O jika direaksikan menjadi NH4OH)
n HCl = M x V = 0,1 M x 250 mL = 25 mmol
Maka jika direaksikan
reaksi 25 25 – 25 25 +
Sisa − – 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.

Maka pH nya dapat ditentukan dengan rumus

[H+] = 5. 10-6
pH = 6 – log 5
Jawaban E
- pH larutan asam sebelum titrasi adalah 3
- pH larutan asam setelah titrasi lebih besar dari 7
- CH3COONa hasil reaksi mengalami hidrolisis
- Konsentrasi Na+ dalam campuran 0,05 M
- pH larutan asam sebelum titrasi adalah 3
CH3COOH merupakan asam lemah, sehingga menentukan pH menggunakan rumusan
pH = 3
BENAR - pH larutan asam setelah titrasi lebih besar dari 7
Karena garam yang dihasilkan CH3COONa terbentuk dari CH3COOH (asam lemah) dan NaOH (basa kuat), sifat garamnya bisa dilihat dari yang kuat yaitu basa atau pH > 7
BENAR - CH3COONa hasil reaksi mengalami hidrolisis
Reaksi CH3COONa dengan air setelah sebelumnya terionisasi
CH3COONa → CH3COO− + Na+
……………………..basa kuat asam lemah (yang bereaksi hanya CH3COO−)
CH3COO− + H2O → CH3COOH + H+
Na+ + H2O → tidak bereaksi
Mengalami hidrolisis parsial/sebagian
BENAR - Konsentrasi Na+ dalam campuran 0,05 M
Menentukan mol CH3COOH dan NaOH sebelum direaksikann NH3 = M x V = 0,1 M x 25 mL = 2,5 mmol
n NaOH = M x V = 0,1 M x 25 mL = 2,5 mmol
Maka jika direaksikanCH3COOH + NaOH → CH3COONa + H2O
mula-mula 2,5 2,5 − –
reaksi 2,5 2,5 – 2,5 2,5 +
Sisa − − 25 25
Karena asam dan basanya habis maka pH ditentukan dari garam yang tersisa (hidrolisis). NH4Cl terbentuk dari NH4OH (basa lemah) dan HCl (asam kuat), sifat garamnya bisa dilihat dari yang kuat yaitu asam.
CH3COONa → CH3COO− + Na+
0,05 M 0,05M
BENAR
Jawaban E
- CH3COONa
- CH3COONH4
- Al2(SO4)3
- NH4CN
- Na2SO4
Larutan garam yang mengubah lakmus merah menjadi biru adalah garam basa yaitu yang terbentuk dari basa kuat dan asam lemah yaitu pilihan A CH3COONa dari CH3COOH (asam lemah) dan NaOH (basa kuat)
Jawaban A
- NH4CN
- CH3COONa
- KNO3
- NH4NO3
Larutan garam yang mempunyai pH < 7 adalah garam basa yaitu yang terbentuk dari asam kuat dan basa lemah yaitu pilihan 4 saja NH4NO3 dari NH4OH (basa lemah) dan HNO3 (asam kuat)
Jawaban D
Larutan NaCl terhidrolisis sempurna menjadi NaOH dan HCl
SEBAB
Kesetimbangan ionisasi terjadi pada larutan asam dan basa lemah
Larutan NaCl jika terionisasi akan terurai menjadi
NaCl(aq) → Na+(aq) + Cl−(aq)
Jawaban D
PEMBAHASAN :
- Konsentrasi larutan NaCN menjadi 0,1 M
Menentukan molaritas setelah pengenceran, menggunakan rumus:
M1.V1 = M2.V2
0,2 M. 50 mL = M2. 100 mL
M2 = 10/100 = 0,1 M
BENAR - Larutan terhidrolisis dengan reaksi
CN− + H2O
NaCN mengalami ionisasi
NaCN → Na+ + CN−
………..asam lemah basa kuat
Na+ + H2O → tidak bereaksi
CN− + H2O → HCN + OH−
BENAR - Konstanta reaksi hidrolisis =

Reaksi hidrolisisnya
CN− + H2O → HCN + OH−
Maka konstanta reaksi hidrolisisnya
Kh =
BENAR - pH larutan = 11
NaCN berasal dari NaOH (basa kuat) dan HCN (asam lemah), maka garamnya bersifat basa
pOH = 3
pH = 14 – 3 = 11
BENAR
Jawaban E
- Natrium asetat
- Ammonium asetat
- Ammonium klorida
- Natrium klorida
Hidrolisis parsial terjadi pada garam yang terbentuk pada asam lemah dengan basa kuat atau garam dari basa lemah dengan asam kuat. Yang termasuk garam yang terhidrolisis parsial adalah pilihan no 1 dan 3. Natrium asetat (CH3COONa) berasal dari CH3COOH (asam lemah) dan NaOH (basa kuat) yang mengalami hidrolisis hanya ion CH3COO−. Sedangkan Ammonium klorida (NH4Cl) berasal dari NH4OH (basa lemah) dan HCl (Asam kuat) yang mengalami hidrolisis hanya ion NH4+
Jawaban B
Tidak ada komentar:
Posting Komentar